
发布日期: 2024-06-18 09:20:43 来源:新产品展示
在我国,截止到2016年4月30日,CFDA总共批准了与质谱技术相关的进口器械12项,国产器械8项。这一数量与诸如生化、免疫、化学发光等技术的大量批件相比实在比例甚微,说明在这一方面在未来会有非常大的增长空间。
质谱技术是19世纪末发现的一项划时代技术,它通过测定物质的分子量而为探索物质的结构提供了丰富的信息。而将分离技术与质谱技术结合则是分离科学的一项突破性进步。比如采用质谱法作为气相色谱(GC)的检测器早已成为一项标准化的GC技术,但由于GC-MS不能分离不稳定和不挥发的物质,所以又逐渐发展出了液相色谱(LC)与质谱连用的技术。到现在,无论是GC-MS,CE-MS(毛细管电泳),还是LC-MS都慢慢的变成了了分析化学领域的常规技术。
与传统的分析化学领域不相同,能够应用于临床检验测试领域的技术不仅要能够很好的满足对物质检测特异性的要求,还要能够很好的满足临床检验对于准确性、重复性和线性度等要求。因此,任何一项能够被国家监管机构批准的临床检测,都不单单是一项技术的革新,而更是一整套具有完备技术说明、工作流程和数据规范的工作系统。
在我国,截止到2016年4月30日,CFDA总共批准了与质谱技术相关的进口器械12项,国产器械8项。这一数量与诸如生化、免疫、化学发光等技术的大量批件相比实在比例甚微,说明在这一方面在未来会有非常大的增长空间。
在目前获批的质谱技术相关批件中,大致上可以分为两大类。一类是针对于小分子代谢物的检测,比如应用于新生儿代谢病筛查的丙氨酸、甘氨酸、25-羟基维生素D,以及同型半胱氨酸等的LC-MS、LC-MS/MS方法;另一类是采用MALDI-TOF(基质辅助激光解吸电离-飞行时间)质谱技术对于大分子(蛋白质)进行仔细的检测的质谱技术,这一技术目前主要使用在于对微生物的鉴定。
随着技术的持续不断的发展,不单单是针对于基因水平的研究越来越深入,针对于蛋白的研究也正在不断的与临床检测具有慢慢的变多的结合。除了现有的ELISA,免疫和化学发光技术,基于质谱的技术在不久的将来一定会在蛋白质、蛋白组学、代谢组学领域成为对蛋白进行定量和监测的最重要技术,而将其应用于临床检验测试领域也将是下一个十年的检验领域的大事件。为此,美国FDA于5月初举办了一次大型的政府-高校-厂家的多方会谈,旨在从监管-学术-生产等多个角度对LC-MS技术在临床应用中的现状、可能碰到的问题以及如何对其进行监管等进行了深入讨论。下文将对此会议内容做简述,为国内相关研究机构、生产企业和政府监督管理的机构提供最新进展。
即使在美国,LC-MS在临床检测中的应用也仅处于起始阶段。根据华盛顿大学教授Andy Hoofnagle提供的数据,在全美7700家获得CAP认证的实验室中,采用LC-MS技术的实验室大约只有不超过200家,比例不超过总实验室数量的2.6%。具体开展项目可参见下表1。

随着技术的慢慢的提升,目前美国能够采用LC-MS进行仔细的检测的蛋白/多肽临床项目有14项,如下表2所示。
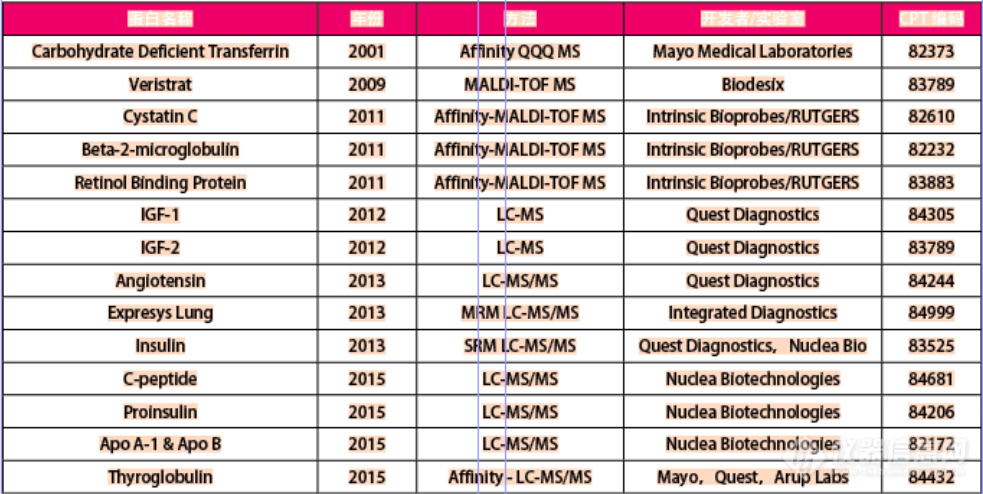
LC-MS技术能否与其他技术一样,在临床应用中得到认可,我们大家可以从某一项具体的检验测试的项目中稍作了解。以25-羟基维生素D为例,可进行此项检测的方法和仪器都有很多种,所以能从CAP的能力验证测试结果对LC-MS的检验测试能力来了解,如下表3所示。
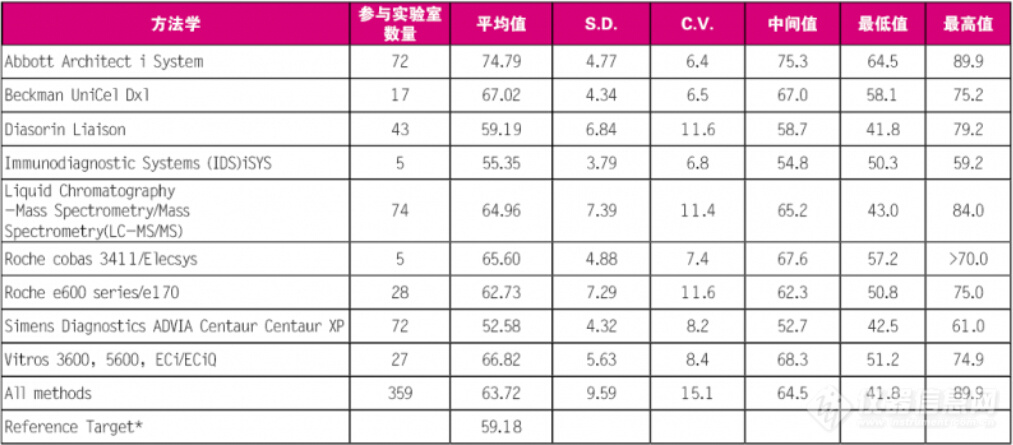
从以上结果能够准确的看出,LC-MS技术能满足能力验证的要求,是可以应用于临床检验领域的。
作为全球最先进的药物监管单位,FDA在此次会谈中也派出了多名官员,从产品分类、注册流程、技术参数等方面对LC-MS的临床注册工作进行了详细的介绍。
在美国,早在1976年的医疗器械修正案就要求所有医疗器械必须合法进入市场,因此1976年之后的所有医疗器械必须全部经过FDA审批,才能进入市场。
至于大家最耳熟能详的体外诊断试剂相关产品(In Vitro Diagnostics,IVD),根据美国联邦法规21 CFR 809.3条款,可理解为是医疗器械的一个亚类,其是旨在用于诊断疾病或其他不适的试剂,仪器和系统,包括对于健康状态的判读,从而用来治愈、缓解、治疗或预防疾病或其后遗症。FDA根据风险,将医疗器械分为三类,第一类为低风险,一般性控制就可以;第二类为中度风险,一般性控制通常还不足够,往往需要进行特殊控制;第三类为高风险,可对患者或使用者造成过度的伤害或疾病风险,以及对生命维持系统和人类健康造成重大损伤。目前要通过FDA批准才能进入市场主要有三种方式,第一种是上市前通告,也就是常说的510(k),另一种是重新审批De novo,还有一种是上市前申请PMA(Pre-Market Application)。
510(k)包括部分I类产品(绝大多数还可以豁免)以及大部分的II类产品(极少数能豁免),FDA根据其是否与之前的上市产品具有“实质性等同”来进行许可,目前,进行此类申请需要先找到一个与申请标的类似的产品(包括计算参数)并有类似的预期使用范围(即,前置产品Predicate)。FDA需要90天来给出答复。最终的决定书概要会公布在官网上。
De novo类别是针对目前市场上还没有前置产品的低风险到中等风险设备。根据具体情况进行I类或II类的划分,需要120天给出答复,De novo产品会成为以后具有相同预期用途产品类型的前置产品。
PMA类别是针对于III类产品的,其不需要前置产品,需要证明其安全性和有效性,可以要求在进行批准前征求顾问委员会的决定,其安全性和有效性数据(SSED)会在官网上公开,需要180天给出答复。
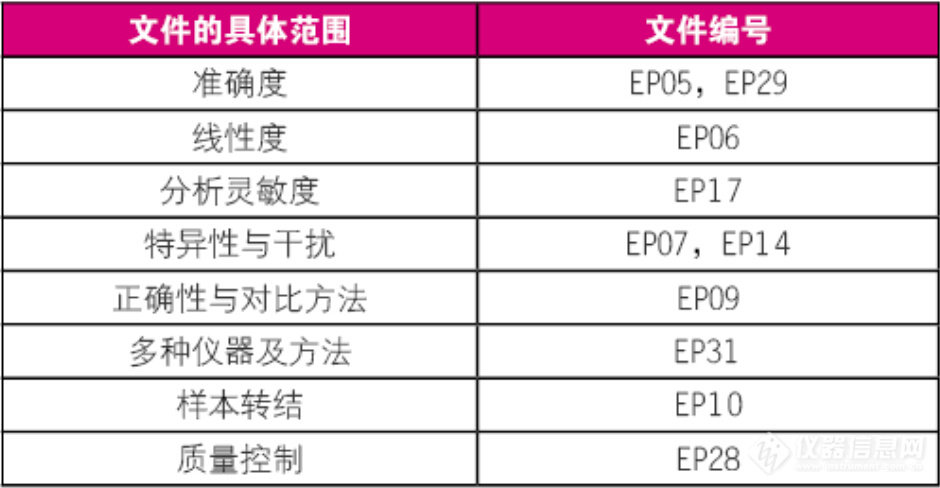
从FDA的角度出发,其职能在于要确保医疗器械、包括IVD产品,能够合理地安全且有效地实现其预期使用目的。所以,对其进行分析性验证是实现注册审批的第一步。具体到LC-MS相关设备及IVD产品时,则主要包括以下关键内容:(1)需要明确阐述何种被检物是通过IVD进行度量或检测的,(2)需要进行IVD检测的样品或样本类型,(3)所申报IVD产品的底层技术,(4)所实施检测的类型(定量检测、定型检测、半定量检测等),(5)适用于所申报测试的患者人群,(6)检测结果的临床目的,包括所提供设备能够检测的疾病/不适(比如,可辅助于(某种疾病/不适)的诊断),(7)所实施检测的参数设置,以及(8)最有可能获得检测结果的参数设置。
1.准确度和重复性就LC-MS相关产品而言,因为其涉及的工作流程通常比较复杂,所以必须特别加以重视。需要考虑到的步骤包括了从样品收集直到最终的数据输出和分析,以及其中的某些特殊环节。
考虑到质谱技术可以一次对多种物质进行检测,因此,从一次质谱测量得到的针对于多个被检物的分析结果,可以被用作多重分析或可将其组合成为一个可接受的结果。但是,如果是多重分析,则要求所有被检物都需要在一个测试中被全部检测出来,而且每一种被检物都要被单独进行评价和报告。例如,来自于患者样本中的一种或多种蛋白,即若干的不同被检物,可作为单独因素合并于某一算法中,从而提供一个最终的、可接受的结果,例如预测某种疾病风险的分数。而FDA通常会需要申请人提供证据,说明每一种被检物对于最终分数的贡献,以及每一种组分在各种浓度组合中对于最终分数的贡献。
2.线形度和回收率对于测量多种被检物LC-MS相关产品而言,无论是单独(通过多种不同的样板,每次测量一个)或者组合(以IVDMIA方式)进行测量,申请人都需要对每一种被检物(独立于其它被检物)进行线形度和回收率的评估。
3.样本的结转根据某项分析的工作流程不同,有可能存在前序样本中含有新的样本,而对申请人而言,则需要对所述工作流程中有可能产生结转的每一步骤都进行鉴定和评价。在FDA之前的受理过程中,的确接到过这样的结转研究,即在包括所述设备的一系列全部工作流程中,在阴性或弱阳性样本中出现了强阳性的情况。
4.检测限/分析灵敏度:空白限、检测限和定量限LC-MS相关产品依赖于质谱仪对于峰值的检测与定量,或液相色谱中随洗脱时间对离子流的测量。这两种测量都离不开对高于系统中化学与电子噪声的峰的检测。在实际情况中,由于缺乏可靠的空白样本,以及LC-MS技术的较低背景噪声,要想确定空白限(LoB,limit of blank)往往是很难实现的;然而,如果某些临床检测的判定点接近于一起的灵敏度极限时,LoB就显得至关重要了。LC-MS产品的检测限(LoD,limit of detection)是采用信噪比的低值计算出来的。在不同的设备中,信噪比往往是不一样的。
5.分析特异性与干扰对LC-MS产品而言,主要有两类干扰物会影响对被检物的测量与定量。一类是存在于样本中的同重离子或近同重离子(isobaric or near isobaric ions),此类离子能够在质谱仪中被同时检测到,从
而对正确离子的检测和定量造成干扰。因此有必要对这些干扰物的存在与否进行评估,从而阐明是否这些干扰物的存在会影响到所述设备的安全性和有效性,还需要考虑到在标准操作条件下质谱仪的分子量分辨率。
6.样品制备对于LC-MS相关设备而言,其样品制备、尤其是涉及到蛋白和多肽的样品制备是非常复杂的,也是在相关分析检测中产生不精确和不可重复性的主要原因。因此,对操作人员、仪器、地点等各种变量进行控制的能力,都会对LC-MS产品的安全性和有效性提出挑战。
7.内标对那些需要进行大量样品制备的LC-MS相关产品而言,内标的加入可以在整个工作流程中对不同步骤进行监控,从而了解被检物的鉴定和定量信息。一般而言,内标的加入时间在整个分析流程中越早越好。内标的加入还可以实现在不同样本、校准品和对照品中对被检物值进行规范化。
8.校准品和对照品校准品是用来将设备的原始输出值转化成被检物浓度的参考,这样的浓度可用于形成具有临床判断价值的数据。除了已知浓度的被检物之外,对照品通常需要含有固定数量的内标,从而能够在校准品和患者样本之间提供相对定量。在本文中,对照品是指对整个体系表现进行验证的材料,即阳性对照和阴性对照。这样的对照品并非是用于LC-MS相关产品流程控制中的标准品或内标。
9.对比方法通常,FDA都会以WHO和/或NIBSC的方法作为某一具体被检物的“金标准”。标准参考方法也通常是指为了获知目标条件有无二采用的最易获得的方法。很多时候,在针对同一种被检物的时候,可以有很多种不同的检测方法,当某一方法具有与提交申请具有相同的预期使用目的时,通常被称为前置方法(Predicate)。考虑到LC-MS设备的输出结果与大多数仪器,例如免疫分析的输出结果不同,因此要想直接对两种仪器进行比较是很困难的。要解决这一难题,且目前还没有金标准或者参考方法的情况下,FDA也可以考虑接受经由与临床“真实”(即,根据目前的各项标准,对某一患者状态的临床全面评估)的仪器性能进行过对比和证实的申请。
10.蛋白/多肽的选择除了少数不需要经过蛋白裂解就能够被轻易检测到的小分子生物活性多肽之外,绝大多数的多肽都是作为完整蛋白的代表。申请人可自行选择最适合于其申报检测项目的多肽,当然这些多肽的生物物理性质会影响其检测项目的表现,包括体内或在工作流程中对于翻译后修饰的敏感性,胰酶水解的速率和效率,多肽在样本和工作流程中的稳定性等等。
11.峰选择峰的选择与评价对LC-MS产品的表现而言至关重要。影响液相色谱洗脱峰分辨率和重复性的因素包括色谱柱的选择,缓冲液,流速和温度等等。FDA之前就曾要求过申请人提交相关数据,证明在临床实验室可能碰到的各种操作条件下,色谱峰的分辨率和重复性能够完全满足审批要求。即使目前缺乏某些内标,FDA也可要求申请人提供数据,确保正确的峰和离子可以被检测和定量。
对挑选色谱峰的软件进行选择和评价也十分关键,尤其是在那些被检物接近于最低定量限的样本中,申请人需要对选峰软件的准确性和重复性进行评估,并理解其重要性。
12.核心IVD组件对LC-MS相关的产品而言,有很多耗材和组件都是必须的,例如色谱柱,胰酶的来源和类型,免疫亲和抗体,免疫耗竭柱等。根据FDA之前的经验,对核心组件中的任意一种进行更换,都会导致分析过程中某种成分的改变,甚至需要对整个分析过程进行重新验证。
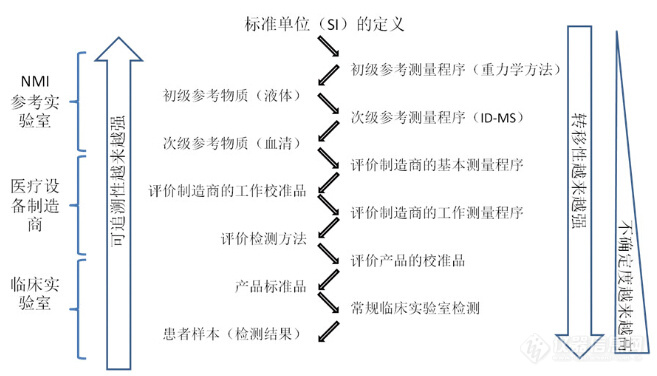
来自美国国家标准与技术研究院(NIST)的Mark Lowerthal也就在临床质谱实验室中实施标准化等内容进行了讨论。主要涉及三个核心问题,第一是需要建立一个参考检测体系,第二是需要使用科学的标准体系,第三是需要建立可追溯的数据链,如下图1所示。
Mark博士也就蛋白/多肽标准品的制备与分析提供了很多有价值的参考数据,比如最适合于作为氨基酸分析标准品的氨基酸可选自,但不限于,丙氨酸、精氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、苯丙氨酸、脯氨酸、酪氨酸和缬氨酸等,以及如何采用LC-UV,即NMR方法进行纯度分析。
利用LC-MS技术对蛋白/多肽进行仔细的检测,最大的难题是来自于对样本的预处理,即对蛋白/多肽进行消化、分离和提取的步骤。来自美国实验室集团(LabCorp)的Christopher Shuford博士通过计算机分析与计算,提出了根据对蛋白序列进行N-连接糖基化、O-连接糖基化、碘化、甲硫氨酸、半胱氨酸位点分析等方法,进而能够在胰酶水解之前对目的蛋白进行更加详细的分析,从而有针对性地进行目的蛋白的富集,进而提高最后的质谱检测灵敏度与特异性。
无论是在LC层析的过程,还是MS检测过程中,每一个峰的产生都是根据检测器对光电信号的响应而得到的,而当样本中的物质较多时,相邻的峰往往会出现叠加或者干扰的情况,这一直都是仪器分析中的难题。来自Indigo BioAutomation的科学家特别就这一问题提供了最新的专业建议。该公司在过去几年中,已经处理了超过10亿张色谱图,针对于LC-MS在临床中的应用,该公司建议首先要避免对原始数据进行修饰,从而能够降低验证的风险,即提供稳定的基线以及采集完整的峰;其次要避免对数据进行调整,从而能进行校正,即能够对某个模型做验证,并可在有效线性范围之外进行稀释;第三对校正过程进行设计,从而获得最好的统计学效果,即如果所得曲线是线性的,则可采用随机的、可重复的水平来测量变异,并据此来表征仪器的状态,或者使用间隔的区间来测量非线性的情况。
质谱技术是目前比较先进的测量技术,能够提供相关仪器的厂家主要有赛默飞世尔(Thermofisher)、安捷伦(Agilent)、沃特世(Waters)、布鲁克(Brucker)、爱博才思(Sciex)和岛津(Shimadzu)公司。但每家制造商对于其设备都有不同的设计,这样就导致在信号采集,数据格式、结果评估等各个环节都不尽相同,很难将其进行比较,更不用说能够进行标准化操作。为了解决这一难题,华盛顿大学的Jarrett Egertson教授带领其团队与上述六家公司进行了长期的沟通、谈判,最终与所有公司都达成了共识,并在NIH的资助下,经过8年时间,开发出了世界上唯一一款能够将各种不同质谱数据进行比对的软件-skyline,使得不同类型质谱之间的数据可以相互比对和验证,大大方便了LC-MS的使用者。该软件现在已包括了400,000开发源代码的峰,还有60,000峰在检测过程中,全球已有超过7000个注册用户。
当然,我们也知道在LC-MS的临床应用过程中,也存在许多亟待解决的问题,比如,样本中的内源和外源干扰物。除了诸如血红蛋白的内源干扰物,来自于患者服用的药物,采血管内的化学成分,以及从干血片上洗脱下来的物质等外源干扰物也都能产生峰,从而在分析和解读过程中对目标被检物峰造成干扰。此外,还有一些其他的干扰因素,比如自然界中的同位素,C-13( 1 Da),Cl-37( 2 Da),在实际工作中是不容易区别开的;有些同(等)重分子,C19H28O2(m/z=288.21)和C18H24O3(m/z=288.17),大多数四级杆质谱仪也不能对他们进行区分;还有一些多电荷的状态,如CHARGESTATE 3(m/z=387.84)和PEPTIDC 2(m/z=387.67)等,也很难通过常规的LC-MS方法得以有效区分。
而且,相对于现在自动化程度较高的生化、免疫和化学发光等方法,LC-MS技术在很大程度上对操作人员能力的要求也比较高,因此在我国的开展还需要循序渐进。
但从技术的进步来看,质谱技术的优势就在于能够准确的对蛋白/多肽进行仔细的检测和定量,而蛋白/多肽相关生物标志物必将成为未来的临床检测新增长点,所以LC-MS技术将会很快得到长足的发展,我们也将对这一领域进行持续关注。